体外抗体发现
- George P. Smith在1985年开创性地在噬菌体表面展示了外源肽段,且未影响其感染宿主的能力,这一发现标志着噬菌体展示技术的重要里程碑。
- 噬菌体展示技术已经利用了多种抗体片段形式,包括单链可变片段(scFv)、抗原结合片段(Fab)、单域抗体(VHH)以及双特异性抗体片段。
| 噬菌体体外展示技术优势
| 体外抗体构建流程
抗体编码区
基因扩增
抗体生物淘选
抗体ELISA
验证与测序
抗体表达纯化
· 噬菌体展示技术
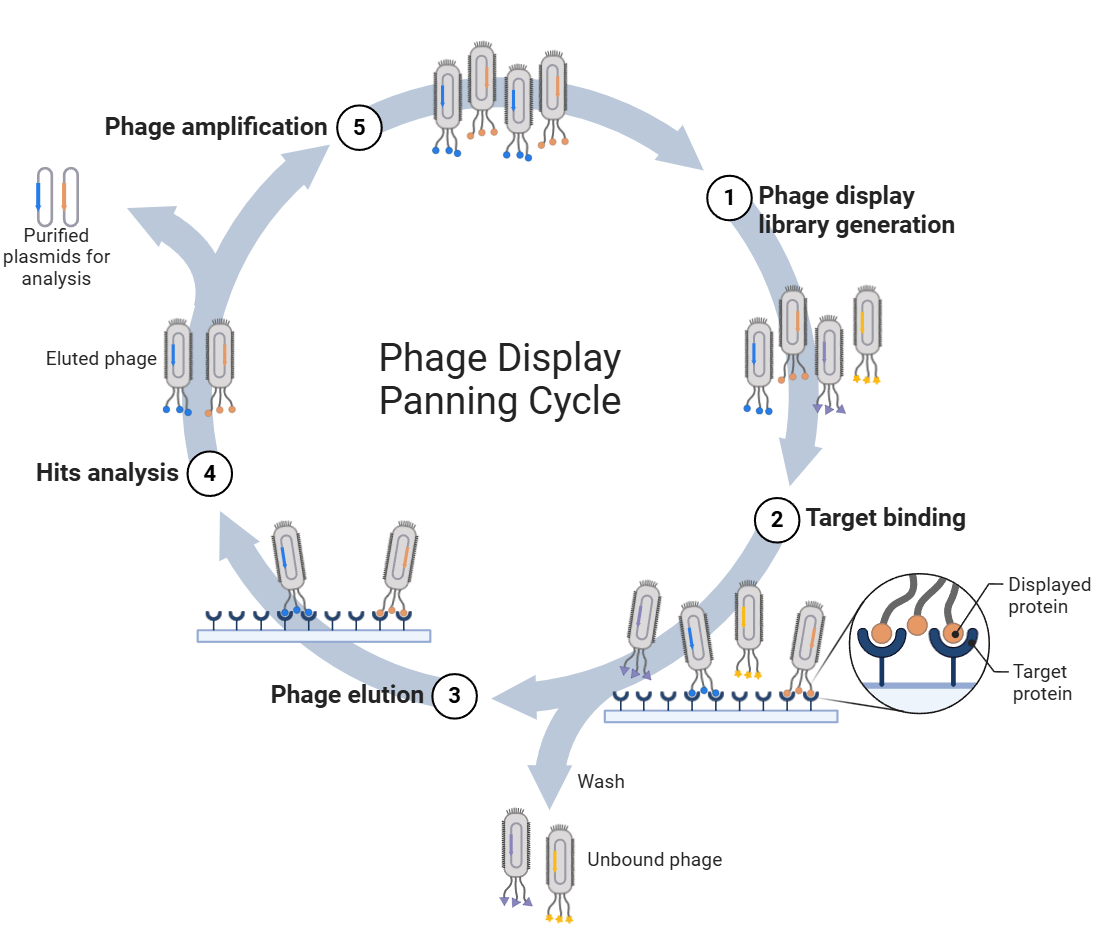
噬菌体抗体库的筛选包括2个部分:
· 第一部分是淘洗(Panning)
即从库中经过几轮吸附、洗脱、扩增后富集到与抗原特异性结合的携带抗体基因的菌株
· 第二部分是筛选(Screening)
即从上一步获得的菌株中挑选单克隆进行特异性和亲和力的ELISA鉴定,以期获得高特异性单克隆
· 噬菌体展示筛选模式
噬菌体展示技术(phage display)是利用基因重组的方法,将目标蛋白的基因重组到噬菌体衣壳蛋白的基因上,最终将目标蛋白以融合蛋白的形式展示在噬菌体的表面。目标分子是通过生物淘选获取,目前常用的淘选方法有固相筛选、液相筛选。
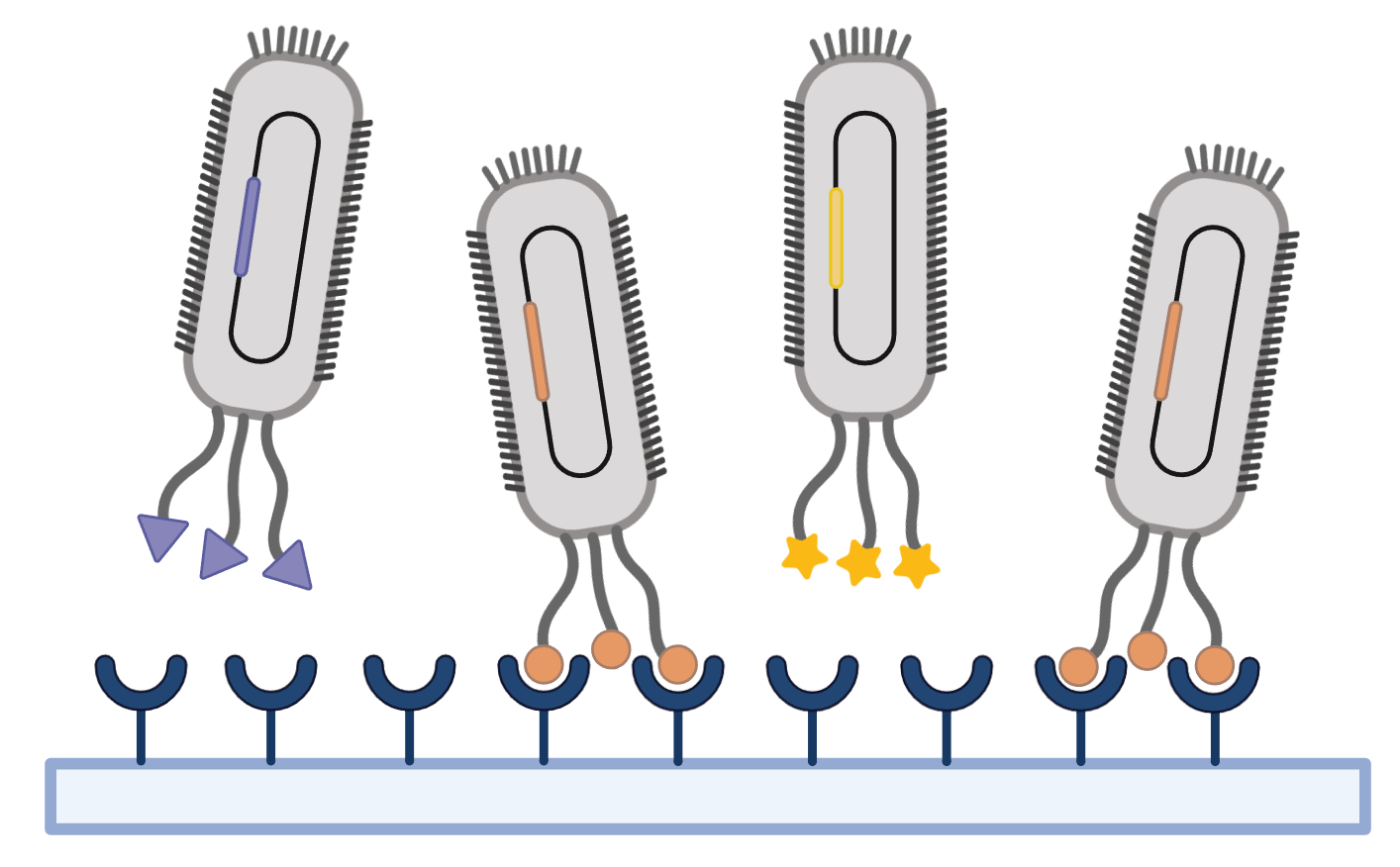
固相筛选
——
足量纯化的抗原或抗体包被在固相介质上(如酶标板、亲和层析柱和免疫试管),然后再加入构建或商品化的噬菌体抗体库孵育,经过多次“吸附-洗脱-扩增”,增加竞争难度,洗去非特异性结合或结合力弱的噬菌体,回收结合的高特异性噬菌体抗体。
液相筛选
——
因其特异性强,结合快速等特点,生物素与链霉亲和素系统被应用于液相筛选。利用生物素标记的抗原在溶液中结合特异性重组噬菌体,再利用亲和素偶联的琼脂糖或亲和素偶联的磁珠来捕获与利用生物素标记的抗原结合的重组噬菌体,从而实现对抗体库中功能抗体的富集。
· 噬菌体展示淘选策略
噬菌体噬菌体展示最大的优势就是可以根据我们想要的结果来进行偏向性的筛选,因此筛选策略非常重要。对于筛选方法,常见的有负筛选,竞争筛选,交叉筛选等。但若想要获得针对挑战性靶点的分子和具有某些结合特性的分子,我们需要针对性地选择筛选的策略。
在筛选过程中,可能会筛选到针对抗原上的所有物质的结合物,比如标签、融合蛋白和支持基质。为了克服这个问题,通常可使用对非目标进行负向筛选来限制针对目标抗原以外的抗体的富集。例如,在使用链霉亲和素磁珠对生物素化蛋白进行筛选之前,可以将文库预先与链霉亲和素磁珠和生物素化非目标蛋白结合,以减少这种不需要的结合物的比例
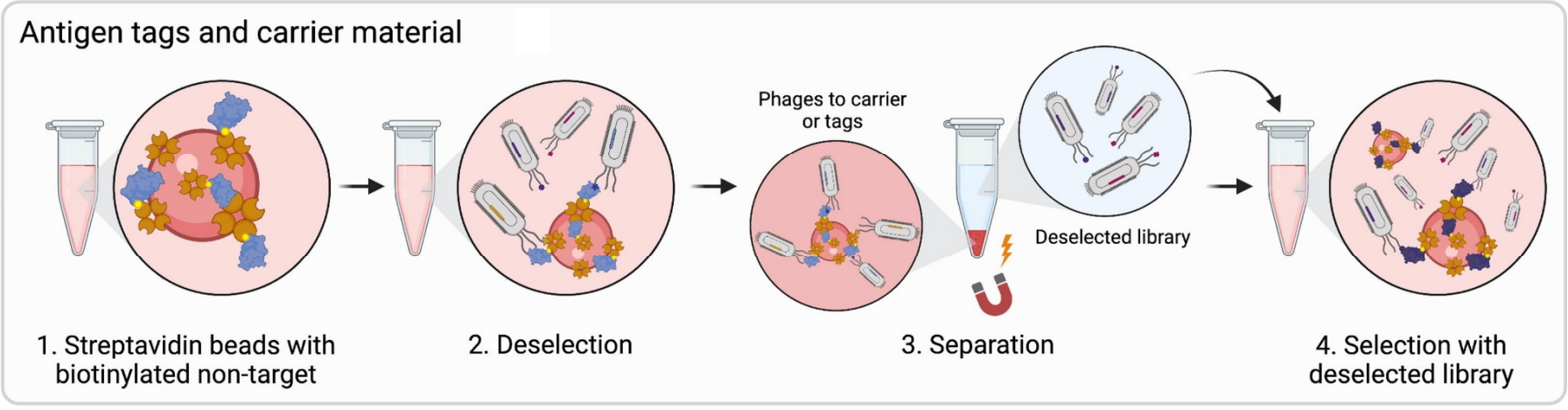
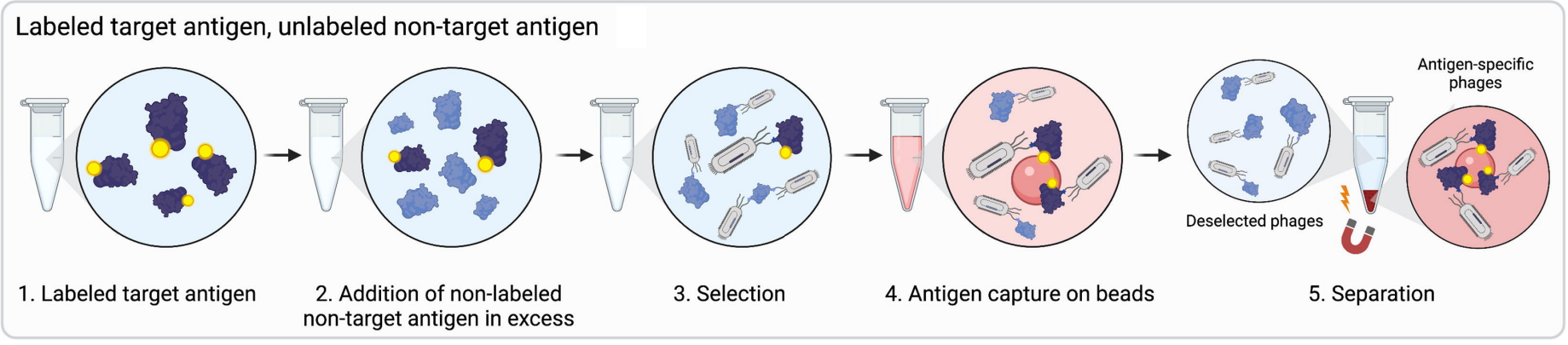
靶标抗原和非靶标抗原与噬菌体抗体库混合,靶标抗原和非靶标抗原会与噬菌体抗体竞争结合。使用过量的非靶标抗原让文库与靶标抗原和非靶标抗原同时孵育,二者竞争结合抗体,提高了靶标抗原结合抗体特异性。在筛选完成之后,与靶标抗原结合的抗体会被富集。
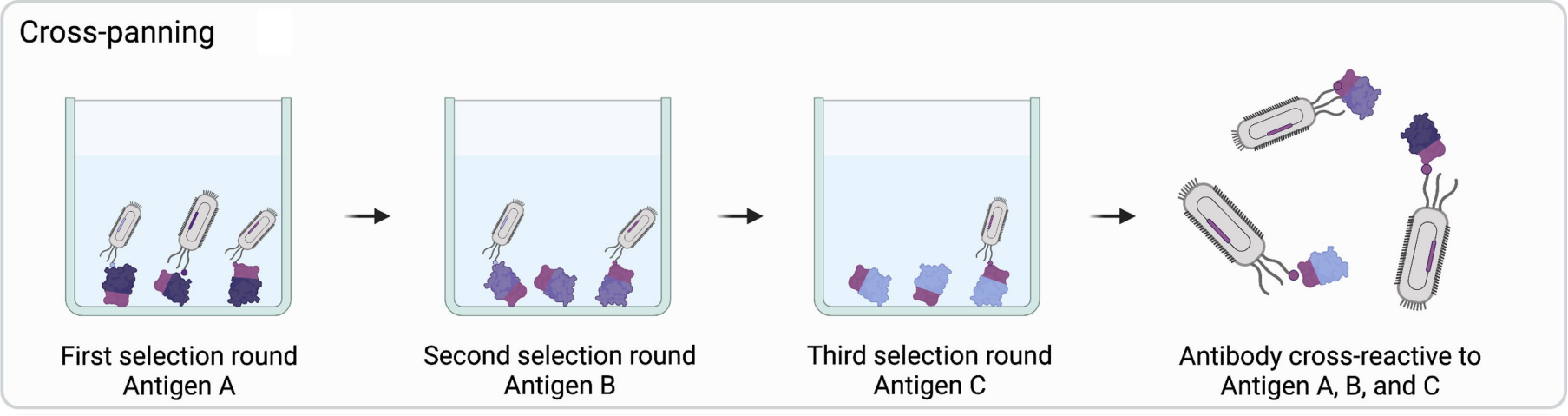
在不同的轮次之间交替使用抗原进行筛选可以得到有交叉反应抗体。但是该方法的达到的抗体可能会特异性低,亲和力差等。
在噬菌体展示技术的基础上,后来又产生了酵母展示技术、核糖体展示技术、哺乳动物细胞展示技术等,这些技术也主要被用于抗体库的构建和筛选。噬菌体和酵母展示技术是最常见的体外展示方法,而这些技术大多只能展示小分子片段抗体,如抗原结合片段(Fab),单链可变区抗体片段(scFv)等,无法展示并筛选全长抗体。哺乳细胞展示抗体的技术,能够展示全长抗体,指导蛋白质的正确折叠,在哺乳细胞中稳定且高水平的表达分泌。

